Elektrolyse: Unterschied zwischen den Versionen
Aus Wiki.sah
Keine Bearbeitungszusammenfassung |
E.T. (Diskussion | Beiträge) K (Rechtschreibung) |
||
| Zeile 1: | Zeile 1: | ||
[[Bild:Elektrolyse Zinkiodid.jpg|thumb|270px|Beispiel der Elektrolyse mit Zinkiodid]] | [[Bild:Elektrolyse Zinkiodid.jpg|thumb|270px|Beispiel der Elektrolyse mit Zinkiodid]] | ||
Unter der '''Elektrolyse''' versteht man die Aufspaltung chemischer Verbindungen mit dem [[elektrischer Strom|elektrischen Strom]]. Bei der Elektrolyse werden Stoffverbindungen, zum Beispiel Zinkiodid, in ihre Bestandteile, also hier [[Zink]] und [[Jod]], getrennt. Sie sammeln sich | Unter der '''Elektrolyse''' versteht man die Aufspaltung chemischer Verbindungen mit dem [[elektrischer Strom|elektrischen Strom]]. Bei der Elektrolyse werden Stoffverbindungen, zum Beispiel Zinkiodid, in ihre Bestandteile, also hier [[Zink]] und [[Jod]], getrennt. Sie sammeln sich jeweils an einem der elektrischen Pole. Iod gibt seine [[Valenzelektron]]en ab, diese wandern über die Kabel zum Zink, sodass anschließend beide Stoffe [[Neutrale Ladung|neutral]] geladen sind. | ||
{{Glossar (Chemie)}} | {{Glossar (Chemie)}} | ||
Aktuelle Version vom 15. Januar 2007, 10:13 Uhr
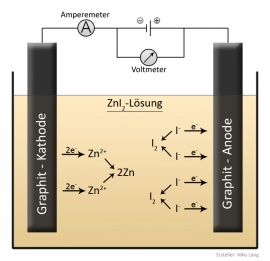
Unter der Elektrolyse versteht man die Aufspaltung chemischer Verbindungen mit dem elektrischen Strom. Bei der Elektrolyse werden Stoffverbindungen, zum Beispiel Zinkiodid, in ihre Bestandteile, also hier Zink und Jod, getrennt. Sie sammeln sich jeweils an einem der elektrischen Pole. Iod gibt seine Valenzelektronen ab, diese wandern über die Kabel zum Zink, sodass anschließend beide Stoffe neutral geladen sind.